品质至上,客户至上,您的满意就是我们的目标
技术文章
当前位置: 首页 > 技术文章
Plantarray逆境生物表型系统在园艺种质资源领域研究论文集
发表时间:2023-03-03 12:36:18点击:937
来源:北京博普特科技有限公司
分享:
Plantarray是一款基于称重的高通量、多传感器生理表型平台以及植物逆境生物学研究通用平台。该系统可持续、实时测量位于不同环境条件下、阵列中每个植株的土壤-植物-空气(SPAC)中的即时水流动。直接测量根系和茎叶系统水平衡和生物量增加,计算植物生理参数以及植物对动态环境的反馈。系统以有效、易用、无损的方式针对植物对不同处理的反应、预测植物生长和生产力进行定量比较,广泛应用于生物胁迫和非生物胁迫以及植物栽培加速育种研究等,胁迫研究涵盖干旱胁迫、盐胁迫、重金属胁迫、热、冷胁迫、光胁迫以及灌溉/养分、CO2指示、植物健康等领域的研究。

番茄DELLA蛋白PROCERA在保卫细胞中促进气孔关闭
摘要:植物采用气孔关闭和减少生长以避免缺水的损害。生长促进激素赤霉素(GA)的水平降低导致对水分亏缺的耐受性增加,但其基本机制尚不清楚。研究表明,番茄DELLA蛋白质PROCERA(PRO),是GA信号传导的负调节因子,在保卫细胞中通过增加对脱落酸(ABA)的敏感性来促进气孔关闭并减少水分亏缺。pro功能丧失的突变体在缺水胁迫下表现出增加的气孔导度和快速萎蔫。过表达植株组成型的激活稳定的DELLA蛋白(S-della),并表现出相反的表型。S-della对气孔开度和水分流失的影响在ABA缺失突变体sitiens(sit)中被强烈抑制,表明S-della的这些作用是ABA依赖性的。尽管DELLA对ABA水平没有影响,但与野生型相比,S-della中的保卫细胞ABA反应性增加,而pro植物中的保卫细胞ABA反应性降低。在保卫细胞特异性启动子的控制下表达S-della足以增加气孔对ABA的敏感性并在缺水胁迫下减少水分损失,但对叶片大小没有影响。这一结果表明DELLA促进气孔关闭独立于其对生长的影响。
关键词:气孔调节;DELLA蛋白;保卫细胞;ABA

1.番茄DELLA pro功能丧失的突变体在缺水条件下表现出快速失水
为了研究DELLA对植物水分状况的影响,本文测试了DELLA功能丧失的番茄突变体pro(Bassel etal.2008)对缺水胁迫的反应。在缺水处理开始之前,将所有植物灌溉至饱和。4d后,未灌溉的pro植株开始萎蔫,而对照植株生长正常(图1A)。干旱处理开始后第4天,pro的叶片相对含水量(RWC)降低了30%;而M82降低了10%(图 1B)。上午10点在pro植株中测得的气孔导度比M82的值高50%(图 1C)。使用称重传感器(蒸渗仪)监测温室中灌溉植株的全株蒸腾作用,同时记录每株植物的每日称重变化情况。Pro植株的每日蒸腾速率显著高于M82植株的测量值(图1D)。对取自灌溉中的pro和M82植株背面叶表皮的印记进行显微镜分析显示,pro(72 μm2) 植株的气孔面积远大于M82植株(37μm2;图1E)。 pro气孔略大于M82,二者密度相近(补充图1)。这些结果表明,在pro中观察到的快速失水是由于气孔孔隙面积增加,进而导致气孔导度和蒸腾作用增加。

图2. DELLA 活性促进保卫细胞对 ABA 的反应
在灌溉与缺水条件下M82、pro和proΔ17叶片中的ABA含量没有显着差异(图 5A),表明DELLA不会促进番茄叶片中ABA的积累。用不同浓度的ABA处理M82、pro和rgaΔ17叶片的去皮远轴表皮条,发现三种植株的气孔孔径均有不同程度的减小,这些结果表明DELLA活性影响保卫细胞对ABA的反应。除了对气孔关闭的影响外,ABA 还促进基因表达,P5CS1和RAB18两种基因在proΔ17保卫细胞中的表达显著高于M82(图 5D 和 5E),表明S-della组成性地促进保卫细胞中的 ABA反应。在H2O2积累的检测中,proΔ17保卫细胞对ABA的反应明显强于M82。在所有的M82、pro 和 proΔ17检查品系中山梨糖醇造成的气孔关闭程度相近(图5F),结果表明DELLA活性不参与ABA独立的气孔关闭。
己糖激酶调节气孔关闭
摘要:气孔由两个保卫细胞组成,其受控运动使植物能够平衡光合作用对CO2的需求和蒸腾作用损失的水分。保卫细胞渗透压增加导致气孔打开,渗透压降低导致气孔关闭。糖类在调节气孔中的作用尚未明确。本文研究了己糖激酶 (HXK)在保卫细胞中的作用及其对气孔孔径的影响。研究表明保卫细胞中HXK的表达增加会加速气孔闭合。研究进一步表明这种闭合是由糖诱导的,并由脱落酸调节。这些发现支持了一种反馈抑制机制的存在,该机制由光合作用的产物,即蔗糖调节。当蔗糖生产速度超过蔗糖加载到韧皮部的速度时,多余的蔗糖被蒸腾流带到气孔并通过 HXK 刺激气孔关闭,从而防止宝贵的水分流失。
关键词:气孔;保卫细胞;己糖激酶;蔗糖;脱落酸;蒸腾作用

图1.己糖激酶 (HXK) 的高表达会增强气孔关闭并减少蒸腾作用
本试验采用不同AtHXK1表达水平的番茄品系研究HXK对番茄气孔的影响。对HK37、HK4和HK38三种番茄品系的气孔孔径和气孔导度进行了测定,它们的HXK活性水平分别是野生型(WT)植株的2、5和6倍。AtHXK1表达系的气孔密度与野生型的气孔密度相似,但气孔孔径和导度均显著降低,这与AtHXK1表达水平直接相关(图1a,b)。此外,对一天中蒸腾作用的持续测量表明,在AtHXK1表达系中,单位叶面积的蒸腾速率显著降低(图1c),因此,单位叶面积的累积全株相对日蒸腾量(RDT)与HXK活性明显呈负相关(图1d)

图2. AtHXK1在叶片中表达时主要降低蒸腾作用
为了排除植株蒸腾作用的减少不是AtHXK1对根吸水或茎部水分运输抑制作用的结果,采用相互嫁接实验,将HK4枝条嫁接在WT的根上,WT枝条嫁接在HK4的根上(图2a)。对嫁接植物单位叶面积的蒸腾速率和累积全株相对每日蒸腾量的持续测量表明,蒸腾减少通常与HK4的枝条有关,而根系的影响较小(图2b,c)。为了进一步检查HK4的茎对蒸腾作用的影响,采用三重嫁接植物,其中 HK4 中间砧木替换了 WT 植物的一部分茎(图2d)。HK4 的中间砧木对RDT没有影响(图 2e),以上表明表达 AtHXK1 植株蒸腾作用的减少是由于叶子蒸腾作用减少造成的,而不是根部吸水量减少或通过茎干运输减弱的结果。 AtHXK1对叶片蒸腾作用的这种影响表明HXK控制影响整株植物蒸腾作用的气孔行为。
水分胁迫下番茄全株蒸腾速率同步、自主和自我调节波动的发展
植物通过快速调节其导水率和蒸腾速率来应对许多环境变化,从而优化水分利用效率,防止因低水势而造成的损害。使用多称重传感器装置、测量数据的时间序列分析和剩余低通滤波方法连续监测和分析生长在控温温室中良好灌溉和干旱期间盆栽番茄(Solanum lycopersicum cv. Ailsa Craig)的蒸腾作用。过滤后的残留时间序列的时间导数产生了整个植物蒸腾 (WPT) 速率的波动行为。 WPT 波动模式与湿芯蒸发率之间的后续互相关分析显示,WPT 速率的自主波动在水分胁迫下持续增加,而这些波动与水分充足时蒸发率的变化对应。
随着蒸腾速率的降低,这些自主波动的相对振幅随着水分胁迫的增加而增加。这些结果支持了最近的发现,即木质部张力的增加触发液压信号,该信号通过植物维管系统瞬时传播并控制叶片电导。讨论了WPT速率同步波动在消除关键木质部张力点和防止栓塞中的调节作用。

图1. 整盆番茄植株(a)、湿芯(b)和恒定负荷(c)中的平滑重量变化率模式
图1a、b、c分别显示了番茄植株、湿芯和放置在称重传感器上的恒定重量的变化率的平滑模式。对四株相邻的番茄植株进行了类似于图2a所示模式的测量,这些植株在同样充足的供水条件下在温室中一起生长(数据未显示)。图1d、e、f 分别显示了番茄植株、湿芯和恒定负载的剩余时间序列(测量的和平滑的重量时间序列之间的差异)。为了排除WPT速率波动只是系统相关噪声的可能性,通过自相关函数检查这些残差的随机性(分别为图1g、h、i)。恒重残差时间序列ek(图1i)的自相关函数在滞后=0时为1,在所有其他滞后时接近于零,此自相关函数形状表明ek确实是白噪声。相比之下,番茄植株和湿芯的自相关函数(分别为图1g、h)在前200个滞后是周期性的,峰值与峰值之间的滞后差异大约为平均为40个。

图2.全植物蒸腾速率(WPT)相对于平滑WPT速率瞬时值的孤立波动:脱水第1(a)天和第4(b)天的植物I,脱水第1(c)天和第4(d)天的植物II
图2显示了脱水第一天和第四天相对于蒸腾/蒸发速率的波动幅度(以下称为相对波动)。相对波动是蒸腾/蒸发速率的孤立波动与平滑蒸腾/蒸发速率之间的比率。蒸发速率的相对波动在蒸发速率较低的清晨时间较大,然后随着蒸发率的增加而减少,在下午晚些时候蒸发率再次降低时其值再次增加(图2e,f)。图2a-d显示,在脱水期间,蒸腾作用的相对波动增加,蒸腾速率降低。在严重干旱条件下,当蒸腾速率较低时,WPT速率的波动可能是暂时的,甚至降低到零(图2b中的相对蒸腾¼–1)。高级脱水阶段蒸腾速率的日相对波动模式(如图2b、d)表明,蒸腾速率在上午相对较低,然后加剧并保持较高水平,在下午晚些时候同样如此。
细胞分裂素活性增加番茄的气孔密度和蒸腾速率
以前关于细胞分裂素(CK)和干旱的研究表明,细胞分裂素对植物适应限制性条件有积极和消极的影响。本研究探讨了CK对番茄(Solanum lycopersicum)植物蒸腾、气孔活动和干旱反应的影响。在干旱条件下,过度表达拟南芥CK降解酶CK氧化酶/脱氢酶3(CKX3)的转基因番茄植株由于全株蒸腾作用降低而保持较高的叶片水分状况。蒸腾作用降低的原因可能是叶片面积减小,气孔密度降低。与野生型植物相比,CKX3过表达植物的扁平细胞更少、更大,每叶面积气孔更少。此外,与未经处理的叶片相比,经CK处理的野生型叶片表现出更强的蒸腾作用,具有更多的扁平细胞和增加的每叶面积气孔数。CK水平的调控不影响气孔运动或脱落酸诱导的气孔关闭。此外,我们发现气孔孔径与保卫细胞中CK诱导的启动子双组分信号传感器(TCS)的活性没有相关性。先前的研究表明,干旱降低了CK水平,我们认为这是一种适应缺水的机制:降低的CK水平抑制生长并降低气孔密度,两者都降低了蒸腾作用,从而提高了对长期干旱条件的耐受性。

图1.AtCKX3 过表达减少了番茄在灌溉和干旱胁迫下的整株蒸腾作用
在正常灌溉条件下,35S>>CKX3 植株的每日蒸腾速率显著低于 M82 植株的测量值(图 1A)。然而,CKs 内源性水平的降低并未影响每日蒸腾速率的模式,这表明二者气孔运动的模式近似(图 1B)。停止灌溉5天后,M82植株的VWC达到33%,同时35S>>CKX3植株达到57%(图1D)。在此时间点对照植株萎蔫,而 35S>>CKX3 植株保持高的 RWC 并完全膨胀(图 2)。转基因植株在整个干旱处理期间保持较低且稳定的蒸腾速率(图 1C),仅在干旱7天后VWC达到30%。因此,35S>>CKX3 植株中蒸腾作用的减少导致土壤中可用水的利用速率减慢。35S>>CKX3 植株的生长迟缓可能是整个植物蒸腾量较低的主要原因。尽管如此,即使将每日蒸腾速率标准化为叶面积以消除植物大小的影响,仍然发现 35S>>CKX3 植株的蒸腾作用显着降低(图 1A)。

图2.在番茄M82植株上施用细胞分裂素6-苄基氨基嘌呤(BA)可提高植株蒸腾速率和气孔密度
番茄M82植株(8周)用合成的CK BA连续处理7天。最后一次BA处理后三天,使用蒸渗仪测量每日蒸腾作用。经过处理的植株在蒸腾速率和gs方面表现出小而显著的增加(图2A,B)。气孔导度的日常模式不受影响(图2B),这表明 BA处理对气孔运动没有影响。对取自幼叶背面表皮印记的显微分析表明,CK处理对气孔孔径没有影响(图2C、D)。该分析还表明,CK增加了气孔密度(图2C、E)。尽管在给定的叶面积中发现更多和更小的扁平细胞和更多的气孔,但二者之间的比率不受BA处理的影响(图2F),表明BA对气孔没有影响。这些结果表明BA通过促进表皮细胞分裂来增加气孔密度。虽然CK处理增加了每片叶面积的细胞总数并减少了扁平细胞的大小,但它对保卫细胞的大小没有影响(图 2C)。由于BA处理对叶片大小或总叶面积没有影响,较高的气孔密度应增加每株植物的气孔总数。综上所述,这些结果表明CK通过增强表皮细胞分裂来促进整株植物的蒸腾作用,从而增加气孔总数。与CKX3过表达的强烈影响相比,CK对蒸腾作用的影响相对较小(图2A、B),这是因为在该实验中只有少量叶子暴露于BA处理,而它们在仍处于细胞分裂阶段。
用于表征植物-环境相互作用的高通量生理表型和筛选系统
本文提出了一个简单有效的高通量实验平台,用于同时和连续在动态环境条件下监测众多植物的土壤-植物-大气连续体中的水分关系。该系统在正常、胁迫和恢复条件以及任意物候阶段,可以在几分钟到整个生长季节的时间段内为阵列中的每株植物提供同步测量的详细生理响应概况。阵列中每个盆的三个探针和专门设计的算法能够对全植物蒸腾作用、生物量增益、气孔导度和根通量进行详细的水分关系表征。它们还可以在动态土壤和大气条件下以高分辨率定量计算整个植物的水分利用效率和相对含水量。该系统没有移动部件,可以适应许多生长环境。本文使用该系统和传统的气体交换工具筛选了与栽培番茄 (S. lycopersicum) 杂交的野生番茄物种 (Solanum pennellii) 的 65 个基因渗入系,证实了该系统的准确性及其诊断能力。鉴于我们对整株性能的遗传调控的理解存在差距,特别是在非生物胁迫下,讨论了这种高通量诊断筛选方法的使用。

图1.蒸渗仪系统

图2.栽培番茄(M82)和绿果野生型 S.pennellii (Penelli) 番茄全株干旱反应的比较
在灌溉良好的条件下,M82的生长速度和蒸腾速率均高于Penelli。在干旱条件下,M82植物的生长速率和累积蒸腾量下降速度比 Penelli 植物快得多(图 2a、b)。当植物暴露于干旱时,与含有 Penelli 植物的盆栽相比,M82 较高的蒸腾速率导致 SWC 减少得更快(图 2c)。与 Penelli 相比,M82 较高的蒸腾速率和生物量增加导致用水分利用效率(WUE)显著降低(图 2d)。M82更高的蒸腾速率不仅与其较大的尺寸有关,还与每单位叶面积的更多蒸腾量有关,因为在对照和干旱条件下,标准化为叶面积 (E) 的蒸腾速率也高于Penelli 植物。在类似的 SWC 条件下,Penelli 植物对干旱的响应比 M82 植物更急剧地减少 E(图 2e)。当植物的蒸腾速率以及整个冠层气孔导度 gsc 标准化为植物的重量时,获得了类似的相对行为。与 Penelli 植物相比,M82 植物更大的冒险行为(即气孔响应对 SWC 减少的敏感性较低)产生较低的抗旱指数(DRI)(图 2f)。当植物达到所需的SWC 时,所有测量都需要大约 2-3 小时。在图 2(e) 中,M82 和 Penelli 的数据平均如下: M82 和 Penelli 在种植后 29天(即预处理的最后一天)取 80% SWC(盆栽容量);由于 M82 和 Penelli 在不同时间达到 45% SWC,我们在每个植株达到 SWC 目标时进行测量。

图3.番茄种群生理特征排序图
比较第一个和第二个板块之间每条线的相对位置交换(分别如图3a、b所示)提供其相对WUE。因此,WUE水平较高的植物在生长速率板块上的具有较高的位置(图3a),而在累积蒸腾板块上的位置相对较低(图3b;e、例如,行MP1),反之亦然(例如IL5-5)。另一个定性参数可以从第二个和第三个板块之间的相对位置移动中得出[即整个植物蒸腾量(图3b)与其在蒸腾作用标准化叶面积图(gsc,图3c)上的相对位置之间的位置互换]。而IL6-2和IL6-2-2从图3(b)的右端到图3(c)的左端急剧向右移动,可能表明气孔控制出现问题。事实上,两个遗传相似的品系都具有很低的DRI(图3d)和很强的萎蔫表型,但并非所有遗传相似的IL植物都表现出相似的表型。

图4.M82和MP1全株不同参数的变化
测量的全株蒸腾速率(E) 和冠层蒸汽传导率 (gsc) 在广泛的SWC值(图4)下产生的MP1与M82的值始终较高。 在冬季重复实验 [温室中的蒸汽压差 (VPD) 类似,但由于自然光条件导致辐射减少约 30%],最大E和gsc的值较低,具有类似的行为植物之间的模式以及植物对不同环境条件的反应。冠层气孔导度的每日峰值gsc(图4e)早于VPD的每日峰值(图4a)。

图5.不同土壤含水量(SWC)水平下的每日水分流入和流出以及全株水分平衡
当前筛选系统的另一个重要特征是通过同时测量流入根部(Jr)和流出树冠(ET)的水流量来评估连续的全株水分平衡表型;图5)。Jr通过连续测量SWC(使用土壤探针)进行评估,ET通过蒸渗仪连续测定的重量进行评估。ET和Jr的连续测量提供了两种通量之间的时间差异以及其随时间变化的视图。进水量和出水量之间的差异被视为衡量整个植株相对含水量(RWC)变化的指标。两个通量之间的差异表明RWC正在减少或增加(图5c和实验程序)。一般而言,两条线路在清晨时段的出水量均高于入水量。流入和流出在上午晚些时候达到平衡并持续到中午时段。 在下午时间段中,进水量高于出水量。MP1和M82植物的每日RWC模式之间的比较表明,在40-50% SWC时MP1的每日RWC增益更大(图5c)。然而,在严重胁迫下MP1植物比M82植物经历了更严重的RWC损失。这些观察结果与手动测量叶片的RWC以及生长速率模式一致。
干旱胁迫下黑松恢复期的转录组分析
林木利用各种策略来应对干旱胁迫,这些策略涉及复杂的分子机制。黑松分布于整个地中海盆地,是最耐旱的松种之一。为了破译黑松用来抵御干旱的分子机制,我们进行了大规模的生理和转录组分析。本文从一个生长条件不理想的半干旱地区选择了一棵成熟的树木进行扦插繁殖。然后使用高通量实验系统连续监测整个植物的蒸腾速率、气孔导度和VPD。在气孔前反应、部分气孔关闭、最小蒸腾、灌水后、部分恢复和完全恢复六个生理阶段对植物的转录组进行了检测。在每个阶段,将暴露于干旱处理的植物的数据与从灌溉良好的对照植物收集的数据进行比较。干旱胁迫下的黑松转录组是使用双端 RNA-seq 创建的。在经过干旱处理的树木和对照树木之间,总共鉴定出约6000个差异表达的非冗余转录本。聚类分析揭示了与光合作用、活性氧 (ROS) 通过抗坏血酸 (AsA) 谷胱甘肽循环清除、脂肪酸和细胞壁生物合成、气孔活性以及类黄酮和萜类化合物的生物合成相关的转录物的应激诱导下调。上调的过程包括叶绿素降解、通过AsA非依赖性硫醇介导的途径清除活性氧、脱落酸反应和热休克蛋白、thaumatin和exordium的积累。干旱恢复诱导逆转录转座子的强烈转录,尤其是逆转录病毒相关转座子Tnt1-94。干旱相关转录组阐明了该物种对干旱和恢复的动态反应,并揭示了新的机制。

图1.干旱和恢复过程中黑松全株蒸腾速率和冠层气孔导度的变化
本文评估了在不同灌溉制度下生长的植物的生理反应。最初,对植物进行7天的充分灌溉,然后暂停灌溉46天,以施加越来越大的胁迫压力,然后恢复灌溉。监测两个主要参数以确定干旱严重程度:中午的E和中午的gsc。与停止灌溉19天后的对照植物相比,干旱处理导致第26天中午E和gsc显著减少(图1)。尽管图1B中的E是五个重复的平均值,图1C中的gsc是单个植物的,但在整个实验过程中E的模式与gsc的模式匹配,并且这两个参数与VPD的每日变化相关(图1)。随着干旱的持续,干旱处理的树木的gsc从第21天的319逐渐下降到第26天的171,并在干旱期结束时降至94 mmol s-1 g-1(图1C)。恢复灌溉后,经干旱处理的树木的E和gsc恢复到干旱处理前记录的水平,表明干旱处理并非结束。在gsc的基础上,选择了两株干旱处理和两株灌溉(对照)树木,在六个不同生理阶段进行分子研究。选择的转录组分析阶段(图1C)如下:(D1)第 21 天的气孔前反应,319 gsc;(D2) 第27天气孔部分关闭,171gsc;(D3) 第 53 天的最小蒸腾作用,94 gsc;(D4) 在第54天用116gsc 灌溉后;(D5) 在第56天部分恢复,271gsc; (D6) 在第69天完全恢复,gsc为523mmol s-1g-1。

图2.响应干旱和恢复的差异表达(DE)转录本
在上述六个生理阶段对干旱处理和对照树木的基因表达谱分析使我们能够分析在干旱处理植物和对照植物之间差异表达的转录本(图2)。一般来说,随着干旱的进展,DE转录物的数量逐渐增加,在恢复过程中逐渐减少。转录下调在干旱响应中占主导地位,而在重新浇水和整个恢复期间,转录上调占主导地位(图2)。在 D1 阶段的干旱处理和对照克隆中仅鉴定出 27 个上调和 27 个下调的转录本。与在 D2 阶段收集的生理数据一致,此时注意到 gsc 减少(图2B),223个转录本上调,而370个转录本下调。在D3阶段,在观察到的蒸腾速率和gsc最低时(图1B和3B),注意到878个转录本的上调和1490个转录本的下调。再浇水几个小时后,在D4阶段,2071个转录本上调,而1505个转录本下调。这些数字在D5阶段(部分恢复)减少到537个上调转录本和510个下调转录本。上调转录本的数量在 D6 阶段(完全恢复)急剧增加至1275,而此时下调转录本的数量已下降至336(图 2A)。总共发现黑松转录组包含 6035个DE转录本,其中2466个先前报道过,3567个是从头组装的。转录组包括1035 (17%) 个无注释的重叠群和 650 (10.1%) 个与逆转录转座元件相关的重叠群。为了识别不同生理阶段常见的转录本,分别为D2-D6阶段的上调和下调转录本生成了两个维恩图(图2C和D)。下调转录本的最高重叠在阶段D3和D4之间,这表明 >50% 的常见转录本表明重新浇水后逐渐恢复。上调转录物的最高重叠D4和D6之间,其中大多数是逆转录转座子。上调转录本的第二高重叠在D3和D4之间,表明重新浇水后逐渐恢复。

图3.干旱和恢复期间黑松中反转录转座子的表达模式
集群20主要由在D4和D6阶段上调的转录本主导。该集群包括1405个转录本,其中646个转录本没有注释。该集群还包括与逆转录转座子相关的489个转录本。这些诱导的逆转录转座子属于HAT、Ty1、Ty3 和Tf2家族(图6)。然而,具有243个相关转录本的最主要的逆转录转座子是Tnt1-94(图6B 和C)。在该簇的其余275个转录本中,8个是TF,44个与光合作用相关,22个过氧化物酶-64转录本,18个核糖核酸酶 (RNase) H转录本和10个内切核糖核酸酶切丁酶转录本。在簇6和27中看到了28个逆转录转座元件的类似模式,它们总共包括130个转录本。
等水和非等水杨树对干旱的生长和生理响应
了解不同的植物在不同的供水条件下如何优先考虑碳增益和干旱脆弱性,对于预测在不同的环境条件下哪些树木将最大限度地增加木质生物量具有重要意义。本文为了评估生物量积累和水分利用效率的生理基础,对Populus balsamifera(BS),P.simonii(SI)及其杂交种P. balsamifera x simonii(BSxSI)进行了研究。在充足水分条件下,非等水杨树(SI和BSxSI)的全株气孔导度(gs)、蒸腾作用(E)和生长速率均高于等水杨树(BS)。在干旱条件下,所有基因型都通过gs的变化来调节叶-茎的水势梯度,同步叶水力传导 (Kleaf) 和 E:等水植物减少了 Kleaf、gs 和 E,而异水基因型保持高 Kleaf 和 E,从而降低了叶和茎水势。然而SI杨树在水分胁迫期间会降低其植物水力传导率 (Kplant),并且与 BSxSI 植物不同,它们从干旱中迅速恢复。干旱条件下等水BS的低gs降低了中等水分胁迫下的 CO2 同化率和生物量潜力。等水杨树在充足的水分条件下生长最快,在水分胁迫增加的情况下光合速率更高,而等水杨树的水分利用效率更高。总体而言,研究结果表明了三种密切相关的生物物种如何应对水分胁迫的策略:存活等水性(BS)、敏感异水性(BSxSI)和恢复性异水性(SI)。讨论了不同环境条件下木本生物量生长、水分利用效率和存活率的影响。

图1.在半控制温室中生长的三种SWCg处理下,三种杨树基因型的 (A) Ψleaf、(B) Kleaf、(C) Kplant、(D) E、(E)gs和(F) AN平均差异
在水分充足的条件下(70–100%SWCg),SI的ψleaf显著低于BS和BSxSI,但三种基因型之间的ψleaf差异在30–49%SWCg下消失(图1A)。因此,只有BS表现出等水行为,保持恒定的ψleaf,SWCg下降(图2A),茎水势(ψstem)表现出相同的趋势。因此,茎和叶之间的水势差(∆ψleaf)在三种基因型之间没有变化:∆当SWCg降低时,ψleaf保持不变,为从茎到叶的水流产生恒定的驱动力(约0.3MPa)。这一行为可能是因为BS在响应下降的SWCg时急剧降低了E和gs,而BSxSI和SI在水分耗尽过程中保持较高的E和gs,因此对下降的ψleaf不敏感(图1D、E和2A、B)。
Kleaf表现出与E和gs相似的模式;当SWCg下降时,SI和BSxSI保持Kleaf相对恒定,而在相同条件下,BS Kleaf下降约50%(图1B)。因此,gs与等量BS基因型中Kleaf的减少一致下降,但gs与两种非等水杨树 Kleaf的减少相关性不那么紧密(图2C)。随着SWCg的降低,只有BSxSI保持恒定的Kplant(图1C)。
通过最大VcmaxJmax(平均值±SE:Vcmax=125.7±5.2µmol CO2 m-2 s-1);Jmax=167.8±8.6µmol CO2 m-2 s-1)比较基因型之间的光合能力没有显着差异。然而,对温室中AN的瞬时测量表明,SI在70–100%时具有较高的AN,BS在30–49%SWCg时具有最低的AN(图1F)。

图2.在半控制温室中生长的三个杨树基因型的(A)SWCg和ψleaf,(B)ψleaf和E,以及(C)Kleaf和gs之间的关系

图3.三种基因型杨树的冠层和叶片形态特征
不同基因型的叶片大小和数量不同(图3A,B)。BS和BSxSI的叶片比SI幼苗大(图3B,C),但SI植株的单株叶片更多,因此SI植株的总叶面积比其他两个基因型的大(图3D,E)。由于总叶面积和气孔密度较低(图3F),BS植株的单株气孔数(即单株气体交换能力)最低,而SI植株的单株气孔数最高。在水分充足的条件下,BS基因型的生长速率也显著低于两种异水基因型(图4D)。

图4. 在半控制温室中良好灌溉条件下生长的三种杨树基因型的(A) 全株累积水分流失;(B) 累积植物增重;(C) 农业 WUE(累积蒸腾与累积增重比);以及 (D) 生长标准化为切割直径(g 鲜重/mm)
为了更好地了解这些形态和生理差异对植物生长速度、水分利用效率和耐旱性的影响,本文测量了整株植物的蒸腾作用、生长速度和WUEa。在水分充足的条件下,SI和BSxSI比BS具有更高的累积蒸腾作用和体重增加(图4A、B、D),这与较高的叶水平E和gs不对应(图1D、E),但可以通过考虑基因型之间不同的冠层形态和气孔密度来解释(图3)。然而,对于给定的蒸腾量等水BS获得了更多的生物量,与等水SI植物相比,产生了更高的WUEa(图4C)。严重水分胁迫(SWCg <30%)的恢复模式表明,BS和SI在灌溉后3-4天内完全恢复,而 BSxSI 甚至在灌溉11天后也没有恢复到其初始蒸腾速率。
柑橘保卫细胞中拟南芥己糖激酶的表达与气孔孔径控制和蒸腾作用减小的关系
己糖激酶(HXK)是一种参与糖感应的糖磷酸化酶。最近的研究表明一年生番茄和拟南芥保卫细胞中HXK介导气孔关闭并协调光合作用和蒸腾作用。为了研究HXK在控制多年生植物气孔运动中的作用,我们在KST1(一种保卫细胞特异性启动子)下培育了表达拟南芥HXK1(AtHXK1)的柑橘类植物。利用GFP作为报告基因,已经证实KST1在柑橘植物保卫细胞中的表达。AtHXK1在柑橘保卫细胞中的表达降低了气孔导度和蒸腾作用,对光合作用速率没有负面影响,从而提高了水分利用效率。本文研究了光照强度和湿度对柑橘根系叶片气孔行为的影响。光合有效辐射的最佳强度和较低的湿度促进了表达AtHXK1的叶片的气孔关闭,支持糖在柑橘气孔调节中的作用。这些结果表明,HXK不仅在一年生植物中协调光合作用和蒸腾作用,而且在多年生植物中促进气孔关闭。

图1.AtHXK1在柑橘保卫细胞中的表达降低了气孔导度和蒸腾作用,对光合作用速率没有负面影响
GCHXK和WT植株通过将转基因或WT茎段嫁接到WT接穗上进行繁殖,并使用LI-COR 6400气体交换系统对嫁接植株进行分析。虽然净光合作用(AN)不受影响(图1C),但GCHXK植物的气孔导度(gs)和蒸腾作用降低(图1A、B),导致内在水分利用效率增加(WUEi;图D),计算为AN/gs的比率。在WT和GCHXK叶片之间未观察到气孔密度或叶面积比的差异,表明较低的气孔导度和蒸腾作用不能归因于叶片形态的变化。随着WUEi的增加,我们希望检查GCHXK植物的生长情况。GCHXK植物的生长似乎在几个月内略有增强(图2A)。为了避免破坏性的测量,我们测量了嫁接点上方的茎的周长(作为生长参数)。嫁接15个月后,GCHXK植株的茎明显变宽(图2B),表明GCHXK植株的生长增强。

图2.在柑橘类植物保卫细胞中表达AtHXK1可促进植物生长
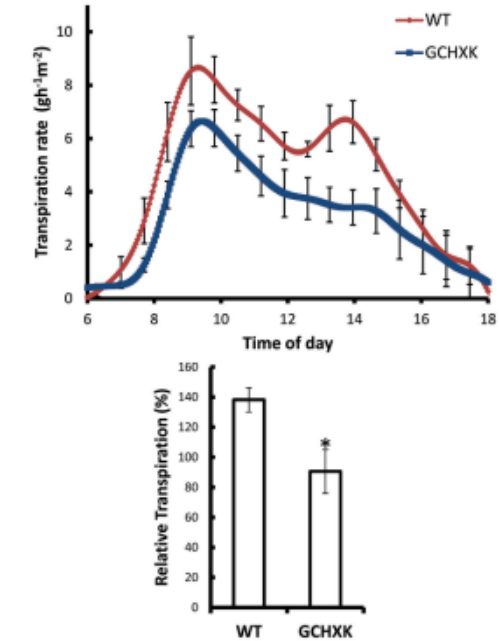
图3.保卫细胞AtHXK1表达降低蒸腾速率
使用精确、灵敏的蒸渗仪系统对完整嫁接的GCHXK和WT植物进一步检查AtHXK1对蒸腾速率的影响。对一天中蒸腾速率的连续测量表明,GCHXK植物的单位叶面积蒸腾速率显著降低(图3A),而累积的全株单位叶面积日相对蒸腾速率(RDT)也相应降低(图3B)。GCHXK的蒸腾速率在一天中(上午9:00和下午3:00)显著降低(图3A),此时蒸腾量增加和更多的蔗糖被输送到保卫细胞。这些结果表明,HXK在一天中调节柑橘气孔孔径,刺激气孔关闭,可能是对糖水平的反应。

图4.WT和GCHXK叶片在不同光强下的蒸腾速率
HXK的气孔关闭效应被认为取决于通过光合作用产生的糖量。因此,气孔关闭和蒸腾作用可能会受到光照强度的影响。本文使用有根-叶系统来跟踪各种光强度下的蒸腾速率,并假设在最佳光强度水平下,GCHXK叶子的蒸腾速率可能低于WT叶子。 GCHXK和WT叶片的蒸腾速率通过全天连续称重在不同光强度(100、400、600 和 800 μmol/m2 .s)下进行测量。在一天中,每个光强度下的蒸腾速率保持相当一致(图4A-D),这可能是由于生长室内的恒定条件。在低光照强度(100 μmol/m2·s)下,GCHXK 生根叶的蒸腾速率略高于WT 生根叶,在800 μmol/m2·s强度时与WT相似。而在400 μmol/m2·s时,GCHXK生根叶片的蒸腾速率很小但显着低于WT叶片,在 600 μmol/m2·s 时,有根GCHXK的蒸腾速率是WT的一半(图4C),表明气孔孔径显着减少。每个光强度下的恒定蒸腾率使我们能够绘制平均蒸腾率与光强度(图4E)。 WT叶片的蒸腾速率受光照强度的影响显著,在低光照条件下非常低,峰值为600μmol/m2·s,而GCHXK叶片在不同光照强度下的蒸腾速率相对恒定,最低蒸腾速率为600 μmol/m2·s。这些结果表明,HXK 缓和了气孔对光强度的反应,甚至可能在低光强度下增加气孔开度。
高光谱生理表型组学系统:测量昼夜蒸腾速率和昼夜反射率
本研究开发了一种用于监测植物对非生物变化动态响应的新型高光谱生理系统。该系统是一个传感器连接到植物的平台,可以确定一天中的最佳时间,在此期间可以通过光谱方法成功识别生理特征。直接测量的性状包括整个白天的瞬时和每日蒸腾速率以及每日和周期性的植物减重和增重。该系统监测和评估辣椒植物对不同水平的钾肥的反应。在07:00–10:00和14:00–17:00期间,不同处理之间发现了显着的瞬时蒸腾速率差异。同时频繁测量的高分辨率光谱数据提供了关联两个测量数据集的方法。光谱和瞬时蒸腾速率之间的显著相关系数产生了用于捕获的三个波段(ρ523、ρ697和ρ818nm)的选择在上午、中午和下午使用标准化差异公式的蒸腾速率差异。这些差异还表明,当光谱(远程或近距离)测量通常在中午前后进行时(当太阳光照度最高时),并不总能获得最佳结果。当根据植物全天的动态生理状态对光谱测量进行定时时,可以获得有价值的信息,这可能因植物物种而异,在规划遥感数据采集时应予以考虑。

图1.成像平台在植株上方移动时的视图. 该平台由轻质材料制成, 仅需几个小时即可部署.

图2.温室平台上72株辣椒植物的RGB图像.相机从右到左移动,从用于曝光时间校准的白色参考面板开始.
温室的屋顶和侧板由透明的PVC材料制成,可以漫射进来自然光。为了将成本保持在最低限度,本试验修改并安装了一个移动灌溉系统连接到温室天花板的传感器承载平台,以便将摄像机移动到桌子上方一个恒定的速度。移动平台由轻质材料制成,由温室基础设施支撑,没有任何结构变化,使其跨越温室的整个长度(25m)。该平台用紧固件、螺栓和电缆连接,并在几个小时内建成。一台小型笔记本电脑控制相机并收集数据。连接到笔记本电脑的微控制器被编程为在白天每小时运行平台(图1)。

图3.上:示例植物及其周围背景(蓝色)的平均光谱,运行 Otsu 过滤器后没有背景的平均光谱(红色),第二次运行 Otsu 过滤器后没有叶子边缘的植物的平均光谱.下:边界框的直方图和Otsu过滤器计算的值.

图4.白天和不同处理组的平均±SE蒸腾速率
时间为三天的分组分别在上午、中午和下午进行了1041,831,1363 次测量,每个处理均有数百次测量。分组后,不同每日组之间的平均TR仍然存在显著差异(图4)。接下来,通过按处理组分组对数据库进行进一步分区。在中午期间,各个处理组之间没有发现显著差异。然而,在上午所有处理组彼此之间均存在显著差异,而在下午,低钾处理组与中高钾处理组之间存在显着差异(图 4)。

图5. 三个处理组的平均反射率值:三天期间(上午-红色、中午-绿色和下午-蓝色)缺钾(低,虚线)、中等(实线)和过剩(高,虚线)
通过每个组和日周期的平均光谱检查一天时间和钾肥对样本光谱的综合影响(图5(A1-A3))。在可见光和近红外光谱中可以直观地看到各组之间的反射率变化。然而,在SNV转换后,日间光谱差异显著减小(图5(B1–B3)),从而在一天中形成均匀的光谱。绿色波段区域(~560nm)和叶绿素吸收波段(460和680nm)存在微小变化,并且消除了近红外反射率的降低。此外,在~940 nm处出现一个急剧的吸收特征,然后在~970 nm处出现一个平坦的吸收特征,这属于水蒸气和液态水的O-H键第一泛音吸收特征。
“增产”和“保活”生物刺激剂处理干旱胁迫下辣椒植株的动态生理表型
在非生物胁迫下提高作物生产力是农业科学界面临的最大挑战之一。尽管进行了广泛的研究,但对非生物抗逆作物商业转移率的研究产出很低。这主要是由于基因型×环境相互作用的复杂性,特别是能够量化植物对动态环境的动态生理反应能力。大多数现有的表型分析设备使用机器人和自动图像采集和分析来收集信息。然而,它们直接测量整株植物生理特性的能力是有限的。我们展示了一种高通量功能表型系统 (HFPS),该系统能够比较植物在动态环境中对不同环境条件的动态响应,因为它可以直接和同时测量几种处理下与植物的产量相关生理性状。该系统被设计为一对一 (1:1) 的植物单元[传感器+控制器],即每个单独的植株都有自己的个性化传感器、控制器和灌溉阀,能够(i)以高时空分辨率监测每株植物的水关系动力学——以及植株整个生命周期内的环境响应,(ii)由于每株植物的多个独立处理方案,采用了真正的随机实验设计,以及(iii)由于植物或其他物体的静止性而减少人为环境干扰。此外,我们提出了两个新的弹性量化相关性状,也可以使用 HFPS 进行表型分析:蒸腾恢复率和夜间水分重吸收。我们使用HFPS筛选了两种商业生物刺激剂(海藻提取物-ICL-SW和代谢物配方-ICL-NewFo1)在不同灌溉制度下对辣椒生长的影响。生物刺激剂被认为是提高作物生产力的一种替代方法。然而,它们复杂的作用模式需要具有成本效益的田间表型鉴定。两种处理方式(生物刺激剂和干旱)的组合使我们能够评估系统在研究生物刺激剂对耐旱性影响方面的精度和分辨率。我们分析和讨论植物在不同阶段的行为特征,并评估生产力和恢复力之间的惩罚和权衡。在这个测试案例中,我们提出了一个筛选生物刺激剂生理作用机制的方案。

图1.实验装置
(A) 随机实验装置阵列视图,由 72 个装有辣椒植株的测量单元组成。
(B) 系统框图。实心圆圈 - 灌溉良好的植株;空心圆圈 - 干旱恢复条件下的植株。绿色 - ICL-SW 处理过的植株,橙色 - ICL NewFo1 处理过的植株,蓝色 - 对照(无生物刺激剂)植株。所有盆栽表面都被覆盖以减少蒸发,灌溉通过多出口滴头注入土壤,以确保灌溉施肥和生物刺激素的均匀分布。

图2.在整个实验过程中,大气条件和实验进度以系统相对重量表示
采用随机实验设计,定量比较两种生物刺激剂(海藻提取物ICL-SW和代谢物配方ICL-NewFo1)对植物关键生理特性的影响。在两种灌溉条件下下,比较了两种生物刺激剂与对照(无生物刺激剂)的效果:(i)灌溉良好,和(ii)干旱胁迫,从灌溉良好时期开始,然后是控制干旱期和连续恢复期(图2B)。

图3.生物刺激剂对植物蒸腾作用的影响
在良好灌溉期间,所有六组的日蒸腾量均逐渐增加(图3A)。而在实验第13天开始的干旱处理期间,植株的日蒸腾量和VWC逐渐减少(图3A、B)。在实验第31天(恢复期)恢复灌溉后,日蒸腾量和VWC快速增加(图3A、B)。干旱临界值(定义为开始限制蒸腾速率的土壤VWC值 [临界VWC,(θc)])是为遭受干旱的植物确定的(图3C)。对照组和两种生物刺激剂处理VWC值为θc = 0.15,但由于ICL SW处理的植物与其他两组相比VWC下降的模式不同(图3B),二者在不同的时间达到了θc,对照和ICL-NewFo1处理的植株在第22.5天达到θc,ICL-SW处理植物在第21天达到θc(图3B、C)。在第27-29天干旱对处理和未处理植株每日蒸腾速率模式的影响(相对于三个充分灌溉组的蒸腾速率模式)如图3D所示,这表明ICL SW处理的植株在干旱条件下午间(1200至1400小时)的蒸腾速率显著降低,但在充分灌溉条件下达到了明显较高的蒸腾速率(图3E)。在充足的灌溉条件下,ICL-NewFo1处理的植株蒸腾速率介于对照和ICL-SW处理之间,并且在干旱条件下蒸腾速率也有类似的降低(图3E)。

图4.在整个试验期间,平均值±SE计算的整株重量
通过使用所有六组在整个试验期间(36天)计算的植物重量,将蒸腾作用标准化为生物量