品质至上,客户至上,您的满意就是我们的目标
技术文章
当前位置: 首页 > 技术文章
植物表型成像机器人以及导航避障
发表时间:2022-01-24 09:33:01点击:1773
来源:北京博普特科技有限公司
分享:


Small Agricultural Phenotype Robot and Its Navigation and Obstacle Avoidance in Parallel Walls
小型农业表型机器人及其平行墙导航避障
摘要:随着机器人、计算机视觉和人工智能的发展,植物表型研究进入了快速发展阶段。机器人可用于大规模、自动化、可持续的表型采集和数据处理,也受到越来越多的研究机构和国际种子巨头的关注,但目前较为成熟的表型机器人体积庞大且价格昂贵在配置中。虽然它们的准确率高,但普及性较差,难以大规模推广,不利于在更广阔的空间和更多的植物品种收集植物表型数据。另一方面,小型表型机器人成本低,操作简单,更适合大规模推广。目前对植物表型小型机器人的研究主要以小型轮式机器人为主。机器人配备视觉和光学传感器,用于采集植物信息,利用机器视觉和各种传感器实现机器人的运动、定位和避障。本文采用小型轮式移动机器人模拟平行壁上表型采集机器人的导航和避障,并通过仿真实验和真机测试证明了其有效性。
用于作物表型快速检测的移动机器人根据其使用环境可分为实验室型、温室型和田间型三种。实验室型作物表型快速检测机器人系统一般都配备有成像系统。正常情况下,成像系统可在X轴和Y轴上移动,并配备条码阅读器,可全天候、全自动检测裁剪并保存数据。当需要了解作物某一方面的表型分析时,实验室型表型检测机器人系统测得的数据一般较为准确。但是,它的统计能力是有限的。当需要检测的作物过多时,不宜使用实验室型作物表型检测机器人系统。
温室型快速表型检测机器人系统还可用于作物表型数据的全天候、全自动快速检测。一般配备成像系统,可选择红外成像、近红外成像、可见光成像系统。通常情况下,其成像模块包含侧面和顶部两个摄像头,并通过检测物体的旋转来达到3维检测的目的。温室型快速表型检测机器人系统可用于检测株高、株型、叶面积等,也可利用不同的成像系统检测不同植物的其他参数,如光合作用、蒸腾作用等.植物通过条形码进行标记,可以检测和存储整个生长周期的参数。当需要了解植物的生长情况时,只需调用数据库中存储的数据即可。与实验室型表型检测机器人系统相比,温室型作物表型检测机器人系统大大提高了检测速度,但温室作物表型快速检测机器人系统相对昂贵。田间作物表型快速检测机器人系统可以自动对田间作物的表型进行成像,实现定点检测,也可以对植物进行大范围的表型分析。该系统可配置可见光、高光谱成像和激光3D成像,对田间植物进行三维形态分析。当然,它也可以用于植物光合作用的接触测量。
以下文章介绍了几种用于作物表型快速检测的移动机器人系统:
A. WIWAM植物表型成像分析系统
WIWAM植物表型成像分析系统是由著名的根特大学VIB研究所、世界知名的自动化工程公司SMO和欧洲著名科学家共同开发生产的新型植物表型研究平台。WIWAM Line是一款高通量可重复表型机器人,如图1所示,用于小型植物的研究,例如小型玉米植株。机器人可以定期灌溉各种植物并测量各种植物生长参数。WIWAM移动式植物表型成像系统是知名的大型移动式植物表型成像系统,四轮驱动,方便田间移动。适用于温室和大田作物的原位表型成像分析和测量。具备WIWAM几乎所有的成像分析功能,还拥有部分表型大数据数据库等,标配RGB成像分析、叶绿素荧光成像分析、多光谱成像,可选配高光谱成像、红外热成像等功能模块、激光雷达成像等,成像高度可调(标准植物最大高度可达1.5m),是大田作物高通量表型分析和植物生理生态研究的重要仪器。因为它使用适合大田的传感器,直接对大田植物或大田栽培作物进行原位成像测量和分析。

图1. WIWAM植物表型成像分析系统
B. Phenomobile——自动植物表型成像机器人
Phenomobile植物表型成像车是一款全自动无人驾驶智能机器人,如图2所示,由法国Hiphen公司自主研发。它是当今世界上自动化程度较高、较先进的高通量现场表型成像系统。Phenomobile可以沿着微型场沿预定义的轨迹运行。RTK GPS定位,精度可达厘米级。Phenomobile采用手动推进或电机脚轮驱动,方便在大型温室或不同室外区域移动使用,大大提高了采样的便利性和效率。该传感器适用于户外,可用于自然光条件下植物样品的成像分析。Phenomobile标配4个功能模块:多光谱成像模块、3D激光扫描三角测量、RGB 3D成像测量、高光谱成像模块,完成作物表型3D建模和成像测量分析。

图2. Phenomobile自动植物表型成像机器人
C. 表型快速检测移动机器人
表型快速检测移动机器人本体由大型三维移动平台和采样系统组成。大型三维移动平台主要包括四个主要部分:龙门架、升降移动平台、运行机构和电气系统。采样系统主要由六自由度操作机器人和摄像系统组成,如图3所示。大型三维移动平台采用门式结构,分段设计,尺寸20m×30m。移动平台承载能力为200kg,可承载多种检测设备(多光谱成像仪、叶绿素检测器、病虫害检测器等),控制系统具有手动和自动行走两种工作模式,并具有配套的用户操作界面。升降式移动平台的功能是将检测仪器定位到感兴趣的点,该点可以准确地找到指定的位置坐标。移动平台设有小车运行机构,可沿主梁行走或上下移动。升降移动平台的末端为安装平台,平台臂上可安装各种作物表型快速检测仪器和机械,用于快速检测植物表型参数。

图3.表型快速检测移动机器人
目前,小型植物表型机器人的研究主要以小型轮式机器人为主。用于收集植物信息的视觉和光学传感器安装在移动机器人上。机器人的导航、定位和避障主要是通过机器视觉和各种传感器来实现,例如北京华清智能科技有限公司研发的野外高通量植物表型机器人以轮式机器人Auto-labor PM1为如图4所示,机器人本体加载了激光雷达、超声波、视觉传感器等各种传感器,机器人通过它们实现了农业温室环境中植物表型和环境数据的采集和监测。此外,用于田间检测的小型机器人Crop-Quant-Robot主要实现田间表型采集,如图4所示。这些研究表明,植物表型的数据采集和研究工作越来越受到关注尤其是在大规模广泛使用的情况下,大型机器人虽然精度高,但普及度较差,而小型机器人成本低、操作简单,更容易推广。本文主要研究了在野外移动的小型轮式移动机器人的导航和避障,并通过仿真和真机测试证明了其有效性。

图4.野外高通量植物表型机器人
Histone 2B monoubiquitination complex integrates transcript elongation with RNA processing at circadian clock and flowering regulators
组蛋白2B单泛素化复合物在生物钟和开花调节器中整合转录延长与RNA加工
摘要:HUB1及其旁系同源物HUB2在染色质介导的发育程序转录调节中,如开花时间、休眠和昼夜节律时钟,以保守的异四聚体复合物的形式发挥作用。KHD1和SPEN3蛋白被鉴定为具有体外RNA结合活性的HUB1和HUB2蛋白的相互作用物。SPEN3和KHD1中的突变体减少了花环和叶面积。值得注意的是在spen3突变体中,开花时间略微延迟,但显著延迟,而在hub1-4突变体中,开花时间提前。生物量和开花时间的突变表型表明,它们各自的调控基因昼夜节律相关1(CCA1)和开花位点C(FLC)的调控解除,这是HUB1介导的组蛋白H2B单泛素化(H2Bub)的已知靶点。事实上,在spen3-1和hub1-4突变体中,通过荧光素酶报告分析观察到昼夜节律周期缩短,CCA1α和CCA1β剪接形式的水平改变,CCA1表达和H2Bub水平降低。在spen3-1突变体中,开花时间的延迟与FLC表达的增强相关,这可能是由于其反义COOLAIR转录物的远端与近端比率增加所致。结合转录组学和双突变分析,我们的数据显示HUB1与SPEN3的相互作用在转录延伸期间与CCA1的前mRNA处理连接H2Bub。此外,FLC上完整的HUB1的存在对于SPEN3在FLC衍生的反义COOLAIR转录物形成中的功能是必需的。
关键词:H2Bub;HUB1 交互组;RNA结合蛋白;RRM 域;KH领域
在真核细胞中,基因组DNA被组织成核小体,由146bp长的DNA组成,这些DNA包裹在H2A、H2B、H3和H4的“核心”组蛋白二聚体的八聚体周围,而接头DNA和组蛋白H1连接相邻的核小体。染色质结构是高度动态的,核小体组蛋白尾部修饰,如甲基化、乙酰化和泛素化,可调节RNA聚合酶II(RNAPII) 转录的DNA可用性。拟南芥中活性基因的主要染色质状态由组蛋白 H2B 单泛素化 (H2Bub)、组蛋白 H3 乙酰化和甲基化决定。H2Bub不存在于拟南芥启动子区域,在基因体达到峰值,并且是最大基因表达水平所必需的,这意味着这种组蛋白修饰与转录本延伸特别相关。在酵母中,E3 泛素连接酶 Bre1 和 E2 结合酶 Rad6 形成复合物,催化 H2B-K123 单泛素化。在拟南芥中,近亲 HISTONE MONOUBIQUITINATION1 (HUB1) 和 HUB2 E3 泛素连接酶以及UBC1和UBC2 E2 缀合酶也在复合物中协同作用以单泛素化H2B。在hub1、hub2和 ubc1 ubc2 双突变体中,H2Bub 在 FLOWERING LOCUS C (FLC)/MADS AFFECTING FLOWERING (MAF) 基因处减少,导致FLC/MAF 基因表达水平降低和早花。单泛素化H2B与FLC进化枝基因的基因体特异性相关,并且是增强H3K4me3和H3K36me2以及FLC/MAF 染色质中的转录激活所必需的。引人注目的是,在开花早期的拟南芥 sup32/ubp26 去泛素化突变体中,FLC和亲属的基因表达水平也降低了。FLC上积累的H2Bub标记导致激活H3K36me3标记的消耗和抑制性H3K27me3标记的增加,表明H2B单泛素化和去泛素化及其稳态对于转录本延伸过程中其他激活组蛋白标记的沉积和在正确的基因激活,如酵母Ubp8 去泛素化突变体中所证明的那样。
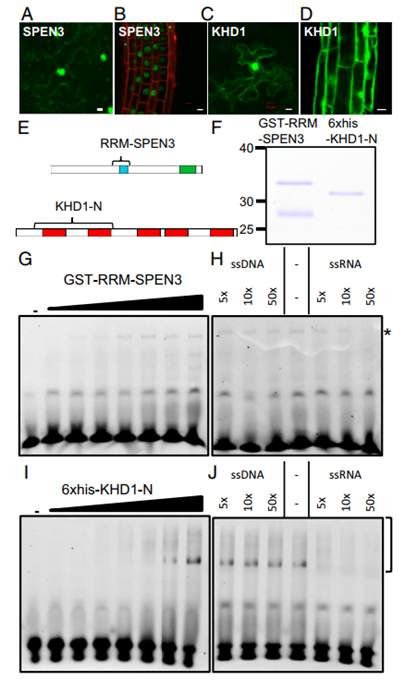
图1. SPEN3和KHD1定位和RNA结合
融合构建体GFP-SPEN3和GFP-KHD1在本氏烟草叶与农杆菌浸润后瞬时表达,并在通过花浸获得的拟南芥系中稳定表达。GFP-SPEN3荧光仅位于叶(图1A)和初生根(图1B)表皮细胞的细胞核中,不包括核仁,而GFP-KHD1荧光发生在细胞核中,不包括核仁,在叶(图 1C)和根(图 1D)表皮中,在细胞核周围的细胞质中,靠近质膜,类似于GFP-HUB1和GFP-HUB2定位。
为了测试SPEN3蛋白的体外RNA结合能力,选择了含有RRM的区域,因为在大肠杆菌中生产全长蛋白证明是不成功的。通过亲和层析表达和纯化GST RRM-SPEN3融合物(图 1E 和 F)。EMSA检测了纯化的 GST RRMSPEN3的RNA结合。将浓度增加的重组蛋白与荧光标记的单链(ss) RNA一起孵育,然后进行EMSA分析,揭示了GST-RRM-SPEN3与RNA 探针的剂量依赖性相互作用,从蛋白质浓度为0.2μM开始(图 1G)。为了测试蛋白质对RNA的偏好,进行了增加未标记ssRNA或ssDNA量的竞争实验(图1H)。在固定浓度的GST-RRM-SPEN3(3μM) 和恒定量的标记RNA探针下形成的蛋白质-RNA复合物通过添加50倍过量的未标记ssRNA来竞争。相比之下,蛋白质-RNA复合物的形成几乎不受添加50倍过量的未标记ssDNA的影响,这表明 GSTRRM-SPEN3 显示出对 ssRNA的偏好,而不是ssDNA
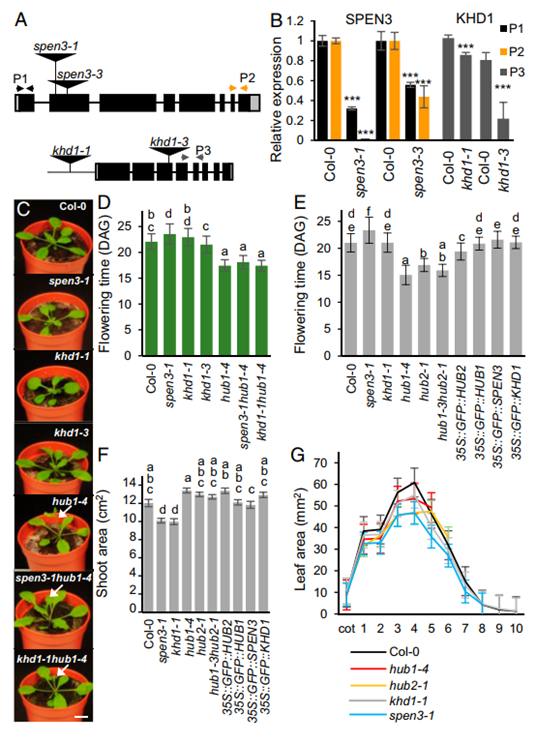
图2. 单突变体和双突变体以及过表达系的表型
将T-DNA插入At1g27750(SPEN3) 外显2且SPEN3转录水平严重降低的 SALK_025388 和 GABI_626H01 系分别命名为 spen3-1 和 spen3-3。将T-DNA 插入启动子的 SALK_046957 系,在 At1g51580 (KHD1) 的 5'UTR 区域旁边,KHD1 转录水平略微但显着降低,被命名为 khd1-1;将 T-DNA 插入 At1g51580 的外显子3并严重降低 KHD1 转录水平的 SAIL_1285_H03C1 系被命名为 khd1-3(图2A和B)。在土壤中生长的发芽 (DAG) 后19天的幼苗在spen3-1、khd1-1 和 khd1-3中的莲座丛生长略有减少,在 hub1-4 和双突变体 spen3-1 hub1- 中开花提前4和khd1-1 hub1-4 与野生型相比(图 2C);在 spen3-3 等位基因中也观察到莲座丛生长减少。在标准生长室条件下在土壤中设置的随机化实验中,在四个独立的生物重复中确定开花时间。通过统计方差分析对基因型进行分组。引人注目的是,在spen3-1 中,开花时间显着延迟了2天(图2D),与hub1-4相比,这是相反的表型,比野生型早4天开花(图2D),如前所示(13); khd1-1 和 khd1-3 突变体具有野生型开花时间。同样在 spen3-3 等位基因中,在相似的生长室条件下的两个独立生物重复实验中观察到开花时间的小但显着延迟。
自动称重、成像和浇水表型平台(WIWAM XY;https://www.wiwam.be)(图 2E)也显示了 spen3-1 开花时间的小但显着延迟、khd1-1 的正常开花时间和 hub1-4 的提前开花。使用自动化 WIWAM 平台在土壤中监测突变株和过表达株系的幼苗生长。在播种后 23 天 (DAS),测量预计的莲座面积(来自拍摄的莲座的所有绿色区域)(图 2F),并计算出粗壮度(叶片形状指标)和紧密度(预计的莲座面积/凸包面积)。
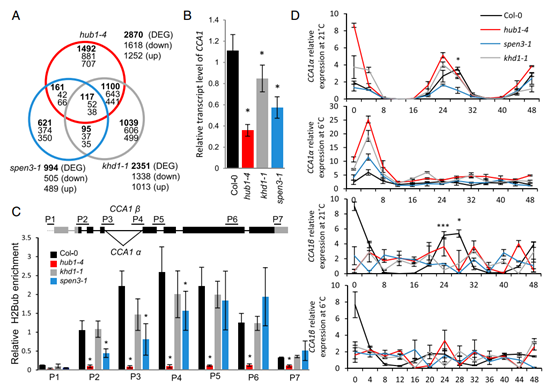
图3. 突变体中的转录组、CCA1 转录本和 H2Bub
在 khd1-1 和 spen3-1 突变体中确定了时钟调节器 CCA1 处的 H2Bub,一个已知的 HUB1 靶标,以研究它是否可以解释突变体幼苗中 CCA1 表达的降低(图 3B)以及 HUB1 /HUB2 介导的组蛋白 H2B 单泛素化酶活性可能在转录延长过程中受到 KHD1 和 SPEN3 的影响。 染色质免疫沉淀 (ChIP) 与 H2Bub 抗体,然后是 qPCR,引物退火到 CCA1 基因的启动子和编码区(图 3C)显示 H2Bub 不存在于启动子中,并且在野生型基因体的中心达到峰值(图3C),但在 hub1-4 突变体中的整个基因上非常低(图3C),尤其是 HUB1/HUB2 靶基因(4)。在spen3-1 突变体中,降低的基因表达与 CCA1 基因 5' 和中央部分 H2Bub 的显着减少相关,表明 SPEN3 影响 CCA1 基因座处 HUB1 介导的 H2Bub 活性(图 3C)。随后,通过qPCR测量CCA1α和CCA1β剪接形式在连续光照下48小时的时间过程中的相对转录水平,在hub1-4、spen3-1和khd1-1突变体中分析CCA1的可变剪接和在控制 (21°C) 和冷 (6 °C) 条件下(图 3D)(44、45)。 在 CCA1α 中,第四个内含子被剪接,而在 CCA1β 中,第四个内含子被保留(图 3C)。Col-0 野生型在对照温度下显示两种剪接形式的节律模式,在昼夜节律时间点 CT28 处出现峰值(图3D)。